TORNA ALLA PAGINA INIZIALE DEL CENTRO STUDI GALILEO PER ULTERIORI INFORMAZIONI
 |
TORNA ALLA PAGINA INIZIALE DEL CENTRO STUDI GALILEO PER ULTERIORI INFORMAZIONI |
Principi di base del condizionamento dell’aria
Caratteristiche dell’aria umida
Pierfrancesco FantoniIntroduzione
Come gia' visto, l’aria atmosferica puo' essere considerata una miscela composta sostanzialmente da due gas: l’aria secca ed il vapor d’acqua, anche se in realta' l’aria secca e' essa stessa una miscela formata da una molteplicita' di componenti in varie percentuali. Per determinare le concause che determinano la pressione dell’aria atmosferica nella sua composizione "umida", quindi, si deve tenere in considerazione tale fatto. In particolare va chiarito secondo quale modello di riferimento e' possibile definire alcune delle principali trasformazioni cui l’aria puo' andare soggetta.
L’aria come gas perfetto
Per semplificare il discorso supponiamo di considerare l’aria un gas perfetto. In realta' essa non lo e' (non nel senso che sia "imperfetta"), trattandosi di un gas reale, ma le sue caratteristiche sono abbastanza simili a quelle di un gas perfetto.
Per inciso, ed in maniera abbastanza sintetica, quello del gas perfetto un modello che viene assunto per studiare in maniera ideale il comportamento e le caratteristiche dei gas, in maniera che sia possibile giungere a descrivere in maniera semplificata, ma soddisfacente e sufficientemente aderente alla realt, il loro comportamento quando subiscono determinate trasformazioni. E' quanto succede, ad esempio, nel campo del condizionamento, dove l’aria viene continuamente sottoposta a processi di alterazione delle sue caratteristiche, sia per cause naturali che per azione di trattamenti specifici di tipo meccanico e termodinamico. Un gas perfetto si suppone composto da una quantita' innumerevole di particelle elementari, assimilate a delle sferette di dimensioni estremamente ridotte e di volume assolutamente irrilevante rispetto al volume complessivo del gas. Esse sono in continuo movimento, in maniera rettilinea ma disordinata e caotica, secondo direzioni casuali e tutte ugualmente probabili (vedi figura 1). Queste particelle non esercitano delle forze tra di loro, ma solo sulle pareti del recipiente che le contiene. Contro queste ultime, infatti, esse possono andare ad urtare durante il loro movimento disordinato. Tali urti non portano a nessun tipo di dissipazione energetica per le particelle.
In base a tali ipotesi, come si diceva in precedenza, si puo' studiare con relativa facilita' il comportamento dei gas, descrivendone le trasformazioni e capendone le relazioni di causa-effetto.
Tale modello risulta essere soddisfacente anche per quei gas che, pur non potendo essere definiti perfetti, risultano avere una densita' piuttosto limitata, e che normalmente sono definiti rarefatti.
La pressione di un gas e' dovuta agli urti delle particelle
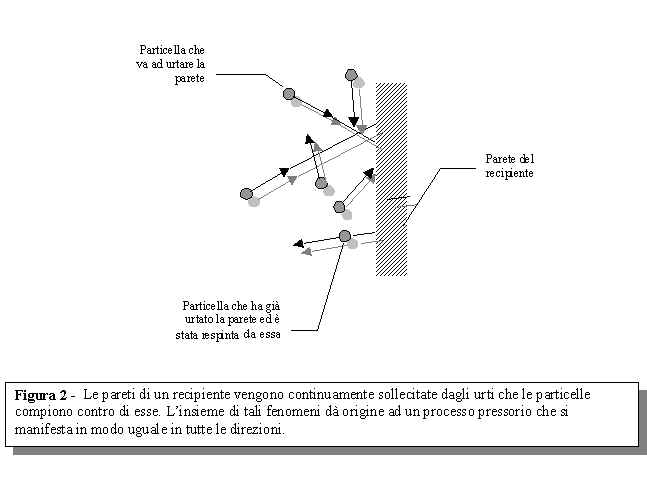
Ogni volta che le minuscole particelle del gas urtano contro le pareti del recipiente esercitano su di esse una forza. Per capire la valenza di tale fatto dobbiamo considerare che in un volume di gas pari a 1 mm3 sono presenti piu' di 10 milioni di miliardi di particelle. Possiamo, quindi, immaginare quale sia l’effetto complessivo di tali urti sulle pareti: un’azione combinata che puo' avvenire secondo qualsiasi direzione ed a cui si d nel suo complesso il nome di pressione. Quindi possiamo immaginare, secondo il nostro modello, che la pressione sia dovuta all’azione che le minuscole particelle che costituiscono il gas esercitano in seguito agli urti che avvengono sulle pareti (come se fossero tanti piccoli chicchi di grandine) a causa del loro movimento disordinato (vedi figura 2).
L’effetto della temperatura
Anche la temperatura puo' avere degli effetti apprezzabili sulla determinazione della pressione del gas. Se un gas viene riscaldato, infatti, l’energia termica che esso immagazzina contribuisce ad aumentare la velocita' delle particelle che lo compongono, le quali, come diretta conseguenza, andranno ad urtare con piu' frequenza contro le pareti del recipiente, dato che esse, in questo caso, sono in grado di muoversi piu' rapidamente. Non solo: aumentando la velocit, nella collisione con le pareti si avra' in gioco una forza piu' grande, dovuta proprio al maggior "impeto" che caratterizza il movimento delle particelle. Da tutto ci ne deriva che, se il volume complessivo del gas rimane costante, allora un aumento della temperatura del gas porta ad un aumento della pressione. Se ci si riferisce alla temperatura assoluta (scala kelvin), in sintesi si puo' affermare che, a volume costante, la pressione e la temperatura assoluta di un gas perfetto risultano essere direttamente proporzionali (seconda legge di Gay-Lussac).
In base a tale conclusione, supponendo di assimilare l’aria ad un gas perfetto, e' possibile considerare la pressione e la temperatura dell’aria strettamente collegate in tutte quelle trasformazioni relative alla climatizzazione in cui il volume dell’aria stessa possa essere ritenuto costante.
Ma se il volume varia?
Appare evidente che la situazione cambia se il gas, in seguito al riscaldamento, puo' espandersi. Ci significa che le particelle che compongono il gas possono urtare una superficie piu' ampia del recipiente che le contiene. Quindi, a parita' di numero di particelle presenti in un dato volume e a parita' di riscaldamento, la frequenza di tali urti risultera' essere minore che nel caso precedente. Oppure, a parita' di urti, interessera' una superficie maggiore del recipiente. Sulla base di ci possiamo pensare che la pressione che il gas esercita sul recipiente non aumenti in relazione all’aumento della temperatura come nel caso precedente. Anzi, come riusci' a dimostrare l’italiano Volta nel 1793, esiste una legge sperimentale di dilatazione che lega tra di loro la temperatura assoluta ed il volume dell’aria ed il vapore d’acqua. Fu Gay-Lussac che, nel 1800, estese tale legge a tutti i gas. Essa, oggigiorno, e' nota come prima legge di Gay-Lussac e stabilisce che mantenendo costante la pressione di un gas tra il volume e la temperatura assoluta esiste una proporzionalita' diretta: se aumenta la temperatura anche il volume del gas aumenta in maniera proporzionale. Anche tale legge e' di rilevanza fondamentale quando si desidera studiare le trasformazioni che l’aria puo' subire nei trattamenti di condizionamento.